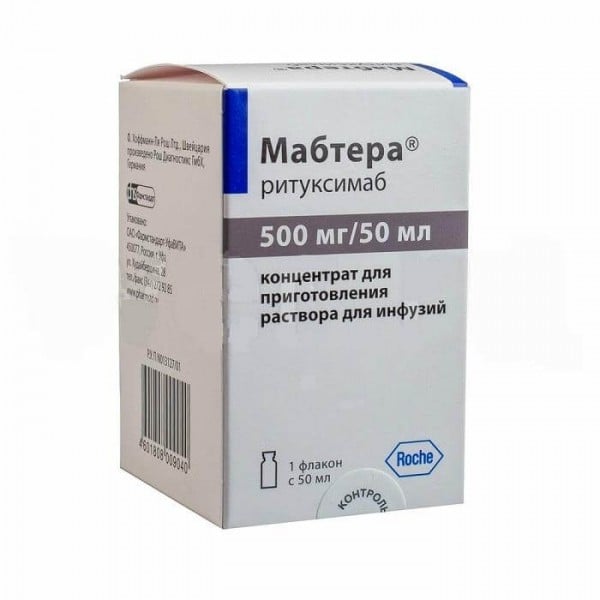
Мабтера 500 мг 50 мл розчин
| Транспортна компанія | ||
- Оплата
- Гарантія
- Умови повернення
Готівкою при отриманні, оплата картою на сайті, накладений платіж
Опишіть симптоми або потрібний препарат — ми допоможемо підібрати його дозування чи аналог, оформимо замовлення з доставкою додому або просто проконсультуємо. Ми — це 28 фармацевтів і 0 ботів.
Так ми завжди будемо з вами на зв'язку і зможемо поспілкуватися в будь-який момент.
Опишіть симптоми або потрібний препарат — ми допоможемо підібрати його дозування чи аналог, оформимо замовлення з доставкою додому або просто проконсультуємо. Ми — це 28 фармацевтів і 0 ботів.
Так ми завжди будемо з вами на зв'язку і зможемо поспілкуватися в будь-який момент.
Властивості препарату Мабтера 500 мг 50 мл розчин
Основні
| Діюча речовина | |
| Торгівельна назва | |
| Кількість в упаковці | 1 |
| Код АТС/ATX | L01X C02 |
| Код Моріон | 58620 |
| Лікарська форма | Концентрат для розчину для інфузій, 100 мг/10 мл по 100 мг/10 мл у флаконах № 2; по 500 мг/50 мл у флаконах № 1 |
| Міжнародна назва | Rituximab |
| Форма випуску | Концентрат для приготування розчину для вливання |
| Об'єм | 50 мл |
| Дозування | 500 мг |
| Фармакологічна група | Антинеопластичні засоби. Моноклональні антитіла. |
Відгуки покупців 3
Опис Мабтера 500 мг 50 мл розчин
Всемирно известная компания Рош (Roche) это один из лидеров по созданию инновационных препаратов в области, в том числе, и онкологии. Компания давно и прочно заняла нишу по производству биотехнологичных лекарственных препаратов. Мабтера 500 мг 50 мл №1– один из ярких примеров высокоэффективного лекарства, созданного с помощью генной инженерии.
Это современное противоопухолевое средство, выпускаемое в форме концентрата для инфузий.
Контактируя с антигеном СD20 на В-лимфоцитах, препарат дает старт иммунным реакциям с последующим распадом B – клеток. Учитывая специфический характер этого антигена Мабтеру применяют при лечении рецидивов неходжкинской лимфомы, либо в тех случаях, когда, когда опухоль является химиоустойчивой.
При использовании приготовленного рабочего раствора пациенту необходимо провести промедикацию, путем введения анальгетиков и антигистаминных препаратов. Раствор вводят внутривенно капельно, струйное введение запрещено.
Приготовленный раствор может храниться до суток при условии соблюдения температурного режима 2-8 градусов по Цельсию, или же до 12 часов при комнатной температуре. Препарат не назначают беременны женщинам и кормящим матерям. С осторожностью проводят инфузии пациентам с сопутствующими заболеваниями органов дыхания и сердечно-сосудистой систем. В этих случаях велик риск развития легочной и сердечно-сосудистой недостаточности. Особого наблюдения требуют гипертоники. В связи с возможной гиподинамией прием препаратов для снижения давления должен быть прекращен за 12 часов до начала инфузии. Так же противопоказанием к назначению Мабтеры или аналогов является гиперчувительность к ритуксимабу.
Применение препарата влечет за собой ряд побочных эффектов, большинство из которых имеют общий характер для химиотерапевтического лечения. Специальных методов лечения в данном случае не требуется, лечение симптоматическое. В процессе лечения в обязательном порядке необходимо проведение лабораторного контроля анализа периферической крови, включая тромбоциты. Это необходимо для поведения своевременной медикаментозной коррекции и предупреждения опасных для жизни осложнений.
При совместном назначении с цитостатическими препаратами суммации общей токсичности отмечено не было. Назначение лечебной дозы и курса лечения проводит специалист в области химиотерапии злокачественных опухолей в условиях специализированного стационара. Основанием для расчета дозировки является площадь тела пациента. Дальнейшая коррекция дозы производиться по результатам клинического течения и лабораторной динамики показателей периферической крови. Лечение ритуксимабом проводится также при хроническом лимфолейкозе, ревматоидном артрите и гранулематозе, сопровождающимся полиангиитом. Схемы лечения и дозировки при этом также рассчитываются специалистами соответствующего профиля.
Цена Мабтера 500 мг 50 мл раствор актуальна при заказе на сайте. Купить Мабтера 500 мг 50 мл раствор в городах Украины: Киев, Харьков, Днепр, Одесса, Ровно, Винница, Запорожье, Ивано-Франковск, Краматорск, Кременчуг, Кривой Рог, Львов, Николаев, Полтава, Сумы, Тернополь, Херсон, Черкассы, Черновцы.
Ціна на Мабтера 500 мг 50 мл розчин актуальна при замовленні на сайті. На apteka24.ua можна купити Мабтера 500 мг 50 мл розчин з доставкою в такі міста України: Київ, Харків, Дніпро, Одеса, Рівне, Біла Церква, Вінниця, Запоріжжя, Івано-Франківськ, Краматорськ, Кременчук, Кривий Ріг, Кропивницький, Львів, Луцьк, Маріуполь, Миколаїв, Полтава, Суми, Тернопіль, Херсон, Житомир, Хмельницький, Черкаси, Чернівці, Чернігів. В інші міста замовлення можуть доставлятися через службу доставки. Доступна доставка кур'єром. Докладніше про способи, вартості та обмеженнях доставки.